2.3-
Pour les paramètres bactériologiques
A l’œil
nu, une bactérie n’est pas visible. Au microscope, elles ne sont pas
identifiables très précisément d’un point de vue taxonomique
(classement des êtres vivants selon leur règne, embranchement,
classe, ordre, famille, genre et enfin espèce). Pour pouvoir les étudier
et les identifier il faut réaliser toute une série de tests et
observations.
Pour cela,
on a besoin de " cultiver " les bactéries, de les
faire croître dans des conditions optimales. On adapte le milieu de culture,
où vont se développer la ou les bactéries. On ajuste ensuite
le conditionnement de ce milieu. Il ne faut pas non plus incorporer les bactéries
de n’importe quelle façon selon l’objectif de la manipulation. Enfin
toutes ne se développent pas à la même vitesse. On adaptera
le temps d’incubation en étuve.
A partir
de cela, on pourra réaliser des tests sur les bactéries elles-mêmes
que l’on aura prélevées dans les milieux de culture.
La croissance
en gélose, milieu solide, donne lieu à l’apparition d’amas de
bactéries que l’on appelle des colonies. Une bactérie donne
une colonie. Il peut cependant avoir confusion si deux germes poussent l’un
à coté de l’autre et se rejoignent. Avec de l’expérience,
on arrive à distinguer si on a une colonie ou un amas de colonies. On
peut ainsi compter les colonies et en déduire le nombre de bactéries
qui étaient présentes dans le volume incorporé au milieu.
2.3.a-
Le milieu de culture
On appelle
milieu de culture, le support qui peut être liquide ou solide,
dans ou sur lequel on apporte les bactéries pour permettre leur développement
puis leur identification.
A l’inverse de la
majorité du règne animal ou végétal, on ne peut
pas identifier précisément une bactérie à sa morphologie.
Cette identification est donc grandement réalisée par les tests
biochimiques.
On cherche à
mettre en avant des caractères propres à chaque germe.
Le milieu
de culture a différentes finalités.
- Les milieux de base.
Ils ont pour but de permettre la croissante d’un maximum de germes. Il n’existe
pas de milieu universel du fait même de l’exigence de certaines bactéries
concernant les nutriments. On choisit donc son milieu en fonction des populations
que l’on veut mettre en avant. En analyse de l’eau, on choisit une simple
gélose nutritive. Elle est à base d’extrait de viande pour
la nutrition des bactéries.
- Les milieux d’isolement.
Ils permettent la croissance de certaines bactéries que l’on veut
plus spécifiquement observées.
On peut
avoir des milieux dits
de base, ils
n’ont pas de caractéristiques précises mais le développement
bactérien à lieu. On peut les utiliser si le milieu est peu chargé.
enrichis en
substance nutritive pour doper la croissance de germes difficiles à obtenir.
La gélose cœur-cervelle permet d’obtenir la croissance des spores de
bactéries anaérobies sulfito-réductrices.
d’identification.
Ce sont les milieux les plus nombreux. Ils assurent la croissance d’un type
bactérien tout en inhibant ou ralentissement la croissances des autres.
La composition en est la principale cause. Jouent aussi la température
et le temps d’incubation. Ils peuvent aussi conférer une couleur aux
colonies qui permet de les identifier.
de conservation.
Ils sont pauvres en nutriments et servent juste à maintenir les souches
en vie ralentie pour les réutiliser ultérieurement et préserver
la collection. On ne peut pas laisser à vitam eternam, il faut
le changer de temps à autre pour que les bactéries survivent.
On régule également la croissance par la température de
stockage.
Ils
peuvent être sous forme de gélose : on a la consistance de
la gelée alimentaire ; ou sous forme de bouillon, c’est à
dire liquide.
La gélose donne
lieu à des colonies en cas de croissance bactérienne et éventuellement
un halo de coloration/décoloration en périphérie de la
colonie. Dans le cas d’un bouillon, on a modification de l’aspect du milieu.
Cette modification peut être due à un trouble ou un changement
de couleur en raison de la prolifération bactérienne.
2.3.b-
Le conditionnement
Les milieux
de culture ne sont pas tous conditionnés de la même manière.
Selon l’utilisation
que l’on veut en faire, la présentation sera différente. Les deux
modes d’utilisation sont en tube ou en boite de Pétri.
En tube
 |
On
a un tube fermé stérilement qui renferme le milieu de culture.
Celui-ci peut être liquide ou gélosé.
On
utilise ce conditionnement pour une très grande majorité
de tests. Prenons par exemple le test de mobilité en milieu Mannitol-mobilité.
On réalise l’ensemencement par piqûre centrale. Le milieu
est orange. S’il y a développement bactérien, on a un virage
au jaune (du à l’acidification du milieu). Si la bactérie
n’est pas mobile, seule la piqûre centrale jaunit ; sinon,
une plus ou moins grande partie de la gélose est décolorée.
On
parle de culot car la gélose est simplement coulée
dans le tube puis refroidie.
Les
bouillons sont conditionnés uniquement en tube.
|
En tube
étroit

Ces tubes
sont utilisés pour déterminer le type respiratoire des bactéries.
L’étroitesse permet de plus facilement contrôler la quantité
d’oxygène présente tout au long du tube. En surface, l’oxygénation
de la gélose est optimale et plus on descend, plus il se raréfie.
Grâce à un trouble ou une décoloration du milieu, on peut
déterminer si la bactérie est
Aérobie :
elle a besoin d’oxygène ;
Anaérobie
facultative : elle a besoin d’oxygène mais tolère les
milieux anaérobie ;
Anaérobie
aérotolérente : elle se développe quelle que soit
la quantité d’oxygène. Elle adapte sa respiration ;
Anaérobie
stricte : elle ne supporte par l’oxygène ;
Microaérophile :
elle supporte l’oxygène en faible quantité mais en a un besoin
vital.
En gélose
inclinée
 |
Il s’agit
d’une gélose que l’on coule puis que l’on solidifie en pente. Cela
a pour but d’observer un développement en surface, en présence
d’oxygène. On peut ainsi ce rendre compte de l’aspect des colonies,
mais on ne cherche pas à les dénombrer ou à les identifier. |
En culot
plus pente
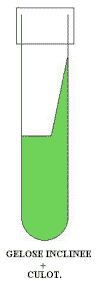 |
Ce système
permet d’observer le développement, ou non, en aérobie et
anaérobie et ainsi de comparer la voie d’attaque d’un élément
en particulier. Par exemple, on ensemence une gélose en culot + pente
pour voir si le germe dégrade une protéine définie.
On observe un virage coloré du culot mais pas de la pente. On peut
en déduire que la bactérie est capable de métaboliser
cette protéine en anaérobiose mais pas en aérobiose. |
En boite
de Pétri
Il s’agit
d’une boite ronde et peu épaisse, de diamètre variable, dans laquelle
on coule la gélose en fusion. Puis, on la referme et, après solidification,
on incube selon les conditions du test.
Il s’agit du support
pour les filtrations. Cette boite a vocation d’isolement et d’identification.
2.3.c-
L’ensemencement
Selon le
conditionnement, on utilisera différentes méthodes.
Le matériel
Avant toute
manipulation, il faut rassembler tout le matériel dont on a besoin. On
l’organise selon le schéma suivant.
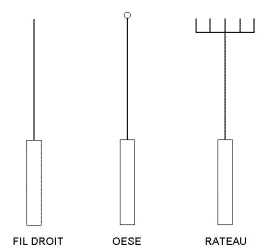

La conserve
permet d’y placer les outils avant de les stériliser par autoclave. Elle
contient de l’eau de Javel ou de l’alcool.
Attention, avant et
après toute manipulation, il faut absolument stériliser
les instruments en les portants au rouge dans la flamme du bec Bunsen
En milieu
liquide
-- On plonge
l’oëse dans la suspension bactérienne réalisée à
partir d’une colonie ou plusieurs colonie que l’on veut identifier ou confirmer.
-- On la retire sans
toucher les parois du tube. L’anneau contient une bulle de suspension avec
des bactéries.
-- On plonge ensuite
l’oëse dans le tube de bouillon. Et on l’agite sur toute la hauteur afin
de répandre la suspension dans tout le milieu.
-- On referme le tube
et on peut le placer en incubation.
On prendra garde à
conserver tous les objets dans la zone stérile du bec Bunsen
et de ne jamais les faire entrer en contact avec la paillasse.
Les embouts des tubes seront passés à la flamme avant et après
toute manipulation, tout comme les instruments.
En tube
 |
L’ensemencement
se fait par piqûre centrale au fil droit après avoir préalablement
chargé celui-ci de suspension. |
En tube
étroit
Les tubes
étroits sont ensemencés grâce à une pipette Pasteur.
Une pipette Pasteur est une canne de verre, cotonnée aux deux extrémités,
afin de maintenir l’extérieur stérile. On l’étire à
la flamme du bec Bunsen pour l’affiner en son centre. On étire dans la
flamme jusqu’à rupture. On sépare les deux parties.
Quand elle
est réussie, elle est longue et assez fine pour atteindre le fond du
tube. Il est préférable de la boutonner : créer une
petite boule de verre à l’extrémité de l’étirement
en la travaillant à la flamme
.
 |
On ensemence
de tube du fond vers la surface, en réalisant un mouvement hélicoïdal,
la suspension bactérienne est libérée progressivement.
La pipette est à usage unique et éliminée via la poubelle
pour produits contaminés. |
En gélose
inclinée
 |
On utilise
l’oëse chargée de suspension selon le procédé
décrit pour le milieu liquide. On réalise des stries sur toute
la longueur de la pente en commençant au fond du tube ; en remontant,
il faut espacer les stries pour " étaler " la
suspension. |
En culot
+ pente
 |
Le culot
est classiquement inoculé au fil droit et la pente à l’oëse
selon le principe de la gélose inclinée. |
En boite
de Pétri
Ce mode
de culture observe plusieurs variantes de techniques d’ensemencement.
-- Par inondation.
Quelques mL de suspension sont déposés à la surface de
la gélose, on la recouvre totalement. L’excès est éliminé.
-- Par étalement.
Utilisé en dénombrement, un volume précis de suspension
(en général 100µL) est déposé à la surface
de la gélose. La goutte d’inoculum est ensuite étalée au
râteau ou avec des billes de verre stériles que l’on retire ensuite
de la boite avant l’incubation.
-- Par la méthode
des doubles couches. La gélose est inoculée par étalement
puis on coule une deuxième couche de gélose en fusion par dessus
la première. On crée ainsi une zone microaérobie.
-- Par incorporation
dans la gélose. On incorpore une quantité connue de suspension
à la gélose en fusion. Après homogénéisation,
on coule en boite de Pétri et on laisse solidifier.
-- Par stries d’épuisement.
On dépose l’inoculum au bord de la boite. A partir de là, on l’étale
à l’aide d’une oëse selon la méthode des cadrans.
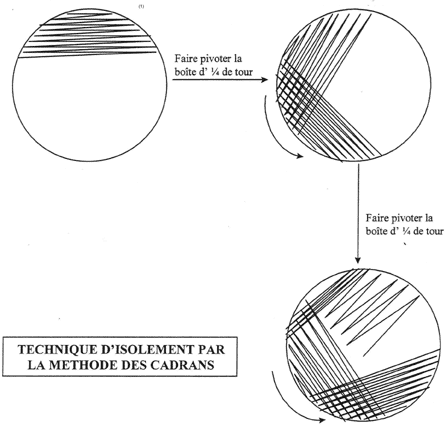
1. Faire un point au marqueur
sur le fond de la boite pour repérer le premier dépôt
2. Etaler une oëse
de culture au niveau du point en faisant des stries serrées toujours
dans le même sens. Flamber l’oëse
3. Faire des stries
serrées toujours dans le même sens en repassant dans le premier
dépôt. Flamber l’oëse
4. Répéter
l’opération (3) comme indiquer sur schéma. Finir par quelques
stries ne recoupant pas le dépôt précédent. Flamber
l’oëse.
-- Par filtration sur
membrane. On filtre un échantillon d’eau et on le pose sur la gélose
de la boite de Pétri.
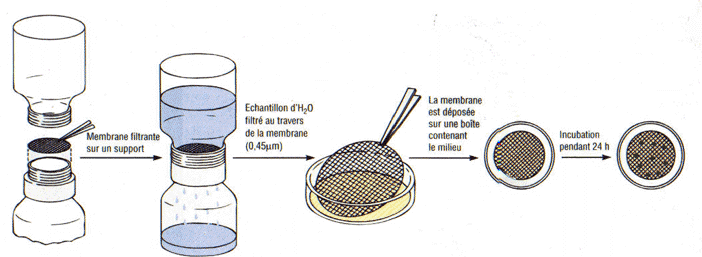
2.3.d-
L’incubation
L’incubation
est le temps et la température qui vont être adoptés pour
une croissance optimale de la population bactérienne voulue.
En hygiène
de l’eau, trois températures sont appliquées.
22°C car
elle caractérise les bactéries adaptées à la température
de l’eau. Elles ne sont donc potentiellement peu ou pas d’origine fécale.
37°C car
il s’agit de la température du corps humain. Les bactéries issues
du tube digestif se développent très bien à cette température
pour peu que le milieu de culture soit adapté. On peut ainsi présumé
une pollution d’origine fécale et donc la présence de germes pathogènes.
44°C car
seuls les germes pathogènes sont adaptés à cette température.
Les germes autochtones ne résistent pas pendant tout le temps d’incubation.
On place
les boites et les tubes dans une étuve qui va réguler et maintenir
la température durant toute la période nécessaire.
Le temps d’incubation
est variable d’un germe à l’autre. On a généralement des
durées variant de 24h à 72h maximum. Ca ne sert à rien
d’attendre plus. Toutes les bactéries viables présentes se seraient
développées.
2.3.e-
Les tests sur lame
Lorsqu’on
a des colonies, on peut les observer au microscope afin d’identifier leur morphologie.
L’état
frais
A partir
d’une colonie mise en suspension ou de l’échantillon s’il est fortement
chargé en bactéries, on peut réaliser un état frais.
On place une goutte de suspension sur une lame de microscope, on place une lamelle
dessus, destinée à étaler la goutte et l’isoler de l’objectif
du microscope. Comme on manipule du matériel biologique, on selle la
lamelle avec de la paraffine.
A l’observation, on
pourra noté la morphologie. Les bactéries rondes sont appelées
des coques et les bactéries allongées des bacilles. Leur organisation
est également visible : si elles sont isolées, par deux,
en amas, en chaînette…
On peut voir aussi
si les bactéries sont mobiles (on peut confirmer ou infirmer les résultats
du milieu Mannitol-mobilité).
Le gram
 |
Ce
test a base de coloration successive est destiné à mettre
en évidence la perméabilité de la membrane des bactéries.
On distingue les Gram+ et les Gram-. Les Gram- voient leur paroi fragilisée
durant les différentes étapes de la coloration : le
cytoplasme (intérieur de la cellule) ne retient pas toute la coloration.
Il apparaît alors rose à l’observation microscopique.
Les gram+ ont
une paroi assez résistante qui conserve les colorants. Le cytoplasme
est coloré en bleu-violet.
Son but est
de classer les bactéries en deux grands groupes en fonction de
leur composition.
Au cours des
manipulations, les bactéries meurent. Il n’est donc pas possible
d’observer les mêmes caractères qu’avec un état frais.
|
L’oxydase
Ce test
permet de mettre en évidence la présence d’une fonction respiratoire :
la cytochrome oxydase. En présence d’une solution de chlorhydrate, elle
produit une quinone (cycle benzénique oxydé) de couleur rose qui
s’oxyde rapidement en un composé violet.
On dépose un
disque de papier filtre imbibé de réactif sur une lame de verre.
On ajoute à l’aide d’une oëse ou d’une pipette Pasteur boutonnée,
une colonie bactérienne.
Si une coloration
apparaît, cela signifie que le cytochrome oxydase est présent chez
cette bactérie. On dit alors qu’elle est oxydase positif (oxydase
+). Dans le cas contraire, on dit que la bactérie est oxydase négative
(oxydase -), elle ne possède pas le caractère.
La catalase
La catalase
dégrade l’H2O2 issu du métabolisme oxydatif
en eau et oxygène. Le dégagement d’oxygène se traduit par
l’apparition de bulles.
On dépose une
goutte d’H2O2 sur une lame. A l’aide d’une pipette boutonnée,
on émulsionne dans cette goutte une colonie prélevée sur
un milieu gélosé.
Un dégagement
gazeux montre que la bactérie possède la catalase. On dit qu’elle
est catalase +. Dans le cas contraire, elle est catalase -.
2.3.f-
A l’œil nu
Lorsque
l’on fait des cultures sur boite de Pétri, des colonies poussent à
la surface de la gélose. Celles-ci peuvent, de par leur morphologie et
leur couleur, donner une première idée du type bactérien
présent.
Pour information,
les colonies peuvent adopter les formes suivantes.
















