
Les paramètres physico-chimiques sont très nombreux aussi bien beaucoup de techniques sont à disposition des laboratoires pour les étudier.
On veut
doser un élément ou plusieurs (ici le calcium Ca2+
et le magnésium Mg2+) dans leur matrice, l’eau.
On ajoute un indicateur
coloré qui va se lier avec l’élément. Pour cette expérience,
on choisit le noir ériochrome (noté ID-) qui
passe de rouge à bleu en présence de Ca2+ et Mg2+.
On dose à l’aide de l’EDTA ou acide éthylène diamine
tétra-acétique
.
Ca2+
et Mg2+ ont plus d’affinité pour l’EDTA que pour l’ID- ;
aussi, ils préfèrent laisser l’indicateur coloré et se
lier avec l’EDTA.
Quand on a autant
d’EDTA que de Ca2+ et Mg2+, l’ID- est tout
seul dans la solution. Rappelons qu’il est bleu en présence du calcium
et du magnésium, coloration qu’il perd quand il est relargué,
pour redevenir rouge.
Concrètement,
on a équilibre des concentrations en Ca2+ / Mg2+
et d’EDTA quand la solution est rouge.
|
La solution d’EDTA est de concentration connue, ainsi on peut remonter à la concentration de Ca2+ / Mg2+ grâce à l’équation CA.VA = CB.VB C
Concentration Application On
a [EDTA] = 100 mg/L. On dose 50 mL d’eau. La chute de burette est de 19.5
mL. ainsi CB = 39 mg/L Remarque : il faut ajouter une quantité très faible de noir ériochrome car il provoquerait une coloration trop intense du fait même de la couleur de la poudre. Ce phénomène rend difficile l’observation du changement de couleur. |
 |
Nous avons mentionné l’ajout d’un indicateur coloré. Mais qu’est ce qu’un indicateur coloré ?
Il s’agit d’un acide faible ou d’une base faible (donc faiblement dissociable dans le milieu aqueux) dont la forme acide et la forme basique ne sont pas de la même couleur.
![]()
En ajoutant
un indicateur en très faible quantité dans un milieu acide, celui-ci
est rouge alors qu’en milieu basique, il serait vert.
On veillera à
ne pas mettre trop d’indicateur pour ne pas perturber les équilibres
de réaction. On met quelques gouttes diluées au centième
voire au millième, ou dans le cas d’un indicateur solide, quelques microgrammes.
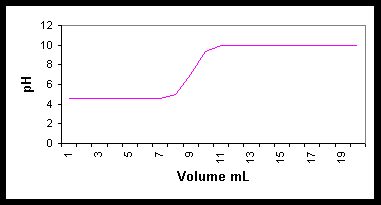
Pour choisir convenablement
son indicateur coloré, il faut connaître la courbe de neutralisation
de l’élément que l’on veut doser.
Alors, on choisira
un indicateur dont le virage coloré se situe sur le saut de pH de l’élément
à doser.
Par exemple :
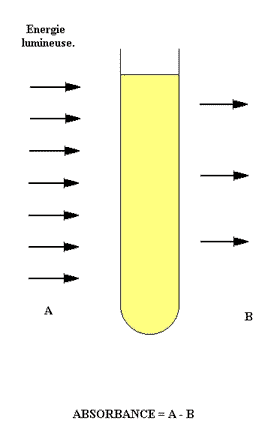 |
Chaque composé absorbe l’énergie lumineuse à une longueur d’onde préférentielle que l’on appelle pic d’absorbance. Le composé va retenir tout ou partie d’un rayon lumineux.
|
 |
On peut également parlé de transmitance. De la même façon, on mesure l’arrivée de l’énergie lumineuse par rapport à l’émission et on a la quantité qui a été transmise => ce qui n’a pas été retenu par la solution.
Reprenons
le cas des agents de surface, on forme un complexe entre la molécule
d’agent de surface et la molécule de bleu de méthylène.
On extrait le complexe de sa matrice grâce à du chloroforme (plus
grande affinité pour lui que pour l’eau en raison de la partie hydrophobe
de la molécule d’agent de surface). Le bleu de méthylène
non complexé reste dans l’eau. Plus la couleur bleue du chloroforme est
prononcée, plus on a de complexe ce qui signifie que la concentration
en agents de surface était d’autant plus importante dans l’eau.
Plus le complexe est
important dans la solution, plus l’absorbance est grande : une grande partie
de l’énergie lumineuse ne traverse pas la solution mais est absorbée
par le complexe.
A l’inverse, la transmitance
est de plus en plus faible avec l’augmentation de la concentration en complexe.
La spectrométrie
est utilisée pour les nitrites avec l’amino-4-benzène sulfonamide
(coloration rose) ou encore les phénols avec l’amino-4-antipyrine (coloration
jaune là aussi avec une extraction chloroformique).
Il s’agit
de techniques basées sur la séparation des composés. On
fait passer la matrice (eau) chargée de ces composés à
analyser à travers un support qui a la capacité de retenir plus
ou moins les solutés qu’elle contient.
Le support d’analyse
est appelé phase stationnaire : elle ne bouge pas et sert
à entraver la migration des molécules et opérer une sélection
selon la taille et l’affinité que les composés ont pour elle.
Selon sa nature, sa
structure chimique, ses groupes fonctionnels (alcool, acide…), chaque composé
réagira différemment.
Les composés
sont entraînés au moyen d’un éluant : la phase mobile.
Il s’agit d’un liquide ou d’un gaz qui circule dans la phase stationnaire et
qui va entraîner l’échantillon. Les composés vont alors
traverser la phase stationnaire jusqu’à un détecteur. Celui-ci
réagit au passage de chaque composé.
Les solutés sont soumis à deux effets antagonistes :
Ils migrent
alors selon un ordre les uns par rapport aux autres et un temps dictés
par le système chromatographique (phase stationnaire + phase mobile).
Les deux phases ne
se mélangent jamais. La phase stationnaire est insoluble pour
garder l’intégrité du système.
On utilise différentes
techniques en chromatographie. En voici quelques unes.
La Chromatographie
Liquide Haute Performance est la technique la plus utilisée dans
les laboratoires car elle est la plus facilement adaptable en routine, facile
à manipuler et un très grand nombre de composés se prêtent
à ce système.
Elle est principalement
utilisée pour les molécules de volume important comme les
pesticides ou les molécules biologiques (que nous n’aborderons pas dans
cet exposé). Ce sont des molécules complexes qui ont un encombrement
stérique (= volume, organisation spatiale de la molécule). On
l’utilise pour les composés thermolabiles = qui ne supportent pas la
chaleur (on ne peut pas les analyser par Chromatographie en Phase Gazeuse).
Les mécanismes de rétention sont régis par plusieurs phénomènes :
- L’encombrement stérique. Plus la molécule est grosse et " tordue ", plus elle aura du mal à migrer dans la colonne au travers des pores de la phase stationnaire.
- La différence de solubilité des composés dans les phases stationnaire et mobile. Si on a une phase stationnaire non polaire (ex : greffon organique) et une phase mobile polaire (eau). On veut rechercher une molécule organique : elle aura plus d’affinité pour le greffon organique que pour l’eau. La molécule est attirée par la phase stationnaire et repoussé par la phase mobile. La rétention est donc importante.
Dans le
même sens, on peut avoir un effet de répulsion du fait, par exemple,
du caractère hydrophobe des molécules. Celles-ci restent à
proximité de la phase stationnaire pour " fuir "
la phase mobile à majorité d’eau. Néanmoins, elles subissent
tout de même sa force d’élution et migrent mais très lentement.
On peut avoir une
augmentation du temps d’élution quand les molécules arrivent à
" s’accrocher " par des liaisons faibles dites liaisons
hydrogène. Elles sont " liées " à la
phase stationnaire et la phase mobile mettra beaucoup de temps à les
entraîner tout au long de la colonne.
L’appareillage.
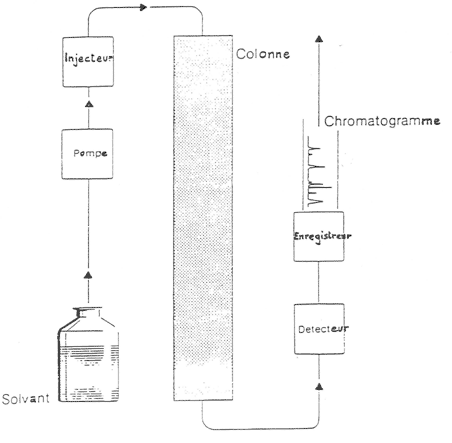
Le solvant. Dans le jargon de chimiste, on parle de phase mobile ou d’éluant. Une pompe assure un débit constant de la phase mobile à travers tout le système.
L’injecteur permet d’introduire un volume TRES précis de solution à analyser. Ce volume est de l’ordre de 40 µL soit 0.04 mL. Ce volume n’est pas fixe mais peut varier selon l’appareillage utilisé.
La colonne, ou phase stationnaire, qui sert à la séparation des composés est assez courte : de l’ordre de 20 cm la plupart du temps.
Le détecteur
permet de repérer le passage d’un composé et d’en informer l’enregistreur.
Celui-ci va stocker les données du détecteur et les restituer
sous la forme d’un graphique : un chromatogramme. On a différent
type de détecteur. Le plus couramment utilisé est le détecteur
à U.V.. Il fonctionne selon les absorbances. Son inconvénient
est que les composés doivent absorbés dans l’U.V. Par exemple,
les alcanes (chaîne carbonée simple) ne sont pas repérés.
Il présente
toute fois l’avantage d’être très stable au niveau signal de détection.
Le détecteur
universel est le détecteur différentiel. Il mesure la différence
de réfraction entre la phase mobile pure et l’éluat. Il est très
sensible aux variations de température et de débit de phase mobile.
Les phases stationnaires.
En chromatographie, on utilise de la silice sous forme de gel de silice poreux. La phase stationnaire est globalement insoluble. On dit globalement car il arrive toujours que des molécules se " détachent " de leur support pour se solubiliser. Ce phénomène est toutefois négligeable et souvent ces molécules retournent sur la silice avant de sortir de la colonne.

Selon cette
structure, le site –OH est le site actif : il provoque la rétention
en attirant les molécules.
L’humidité
contenue dans la silice est très difficilement maîtrisable et mesurable.
Cela est gênant car l’eau est une molécule polaire, elle peut influencer
les molécules passant à proximité et, dans notre cas, perturber
leur temps de rétention.
Pour éviter
cela, on utilise de plus en plus de la silice greffée. Sur l’oxygène
de Si-OH, on greffe une molécule qui n’est pas polaire et rendra plus
facile la maîtrise de la manipulation. On utilise des molécules
de taille variable. Elles peuvent être composées de 2 à
18 atomes de carbone voire même plus.
La greffe se fait de la manière suivante.
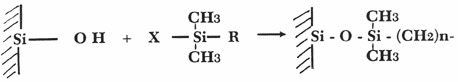
On dit que
l’on a des phases inversées en raison du déplacement de
la polarité dans le système.
En " phases
normales ", la silice est humide ce qui la polarise. On utilise alors
un éluant non polaire comme le méthanol. Dans le cas de phases
inversées, la phase stationnaire porte un greffon qui ne peut accepter
de molécule d’eau, elle est donc non polaire. On utilise alors une phase
mobile polaire : l’eau.
En réalité,
on ne choisit pas entre les deux mais on réalise un mélange selon
les besoins de l’analyse (cf. Optimisation des conditions d’analyse).
Une des autres caractéristiques
de la colonne est sa granulométrie, c’est à dire la taille
de ces pores. On peut imager en disant que la phase stationnaire est une ensemble
de petites billes de diamètre variable selon la colonne, de 5 à
10 µm. Plus cette granulométrie est faible, plus les pics du chromatogramme
sont fins. En effet, les pores qui pourraient retenir les molécules sont
petits, ainsi les molécules ne peuvent pas y rentrer et s’y " coincer ".
Elles migrent donc à peu près toutes en même temps.
Les phases mobiles.
Rappelons
que la phase mobile sert à entraîner, à débit constant,
les composés à travers la colonne.
En HPLC, on utilise
souvent un mélange méthanol/eau dans des proportions variables
que l’on adapte selon les besoins de l’analyse.
Il est capital que
le débit soit constant afin de ne pas faire subir aux composés
une force d’élution variable. Cela pourrait jouer sur le temps d’élution.
Dans le cas de chromatographie
à polarité de phases normale, le composant majoritaire dans l’éluant
sera le solvant organique (dans la plupart des cas, le méthanol) et de
l’eau dans le cas de chromatographie à polarité de phases inversée.
Sur les documents
d’analyse, on note la composition de la phase mobile comme suit :
MeOH/H2O 70/30
Cela signifie que le mélange est composé de 70% de méthanol et de 30% d’eau.
Optimisation des conditions d’analyse
Lors des
analyses chromatographiques, les deux problèmes majeurs rencontrés
sont :
- Le temps
d’élution qui peut être trop long d’un point de vue
adaptation en routine.
- La mauvaise
séparation de deux ou plusieurs composés.
Pour remédier à ces deux problèmes principaux, on a recourt à diverses techniques :
Lorsque
le temps d’élution doit être réduit, on augmente le débit
de la phase mobile afin d’accroître sa force d’élution et ainsi
d’accélérer la sortie des composés.
Cette technique est
très utilisée mais a ces limites. On ne peut pas augmenter infiniment
de débit. Il faut tenir compte des capacités de l’appareillage.
De plus, il y a une limite au delà de laquelle il est physiquement impossible
d’aller en fonction de l’appareillage. C’est un problème de pression
engendrée alors dans le système. Lors de la mise au point de la
technique d’analyse, on réalise une série d’essais visant à
déterminer le débit optimal.
Lorsque l’on recherche plusieurs composés, il peut se produire une sortie quasi simultanée de tous ces composés lorsque le débit est trop important. On a alors un chevauchement des pics voire confusion. L’intégrateur (partie de l’enregistreur) est alors incapable de calculer de façon correcte l’aire du pic et donc, on ne peut en déduire la concentration des composés dans la solution
.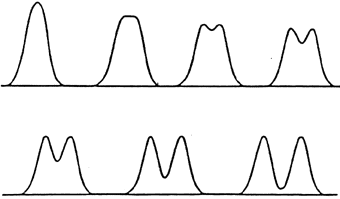
En effet,
pour pouvoir déterminer les concentrations dans les solutions, il faut
qu’il y ai retour à la ligne de base (pas de détection de composé ;
Etat " zéro ") entre deux pics. Ceux-ci doivent être
indépendants et délimités précisément. Sans
quoi, l’intégrateur ne peut donner une valeur précise et exploitable
de l’aire du pic.
Quand on veut réduire
le temps d’élution, on augmente le débit de la phase mobile. Et
bien, à l’inverse, quand on a un chevauchement de pic, on diminue ce
débit pour réduire la force d’élution. Ainsi les composés
" prennent leur temps " pour sortir. Il y a bonne séparation
de ceux-ci dans la colonne.
Il faut savoir ajuster
le débit afin d’obtenir le meilleur résultat possible.
Par exemple,
on va baisser la fraction d’eau de l’éluant pour faciliter la migration
d’un composé hydrophobe. On le rejette moins vers la phase stationnaire
donc sa migration est facilitée.
Lors de l’utilisation
de la nouvelle phase mobile, il faut prendre garde à bien rincer la colonne
pour se mettre dans les bonnes conditions expérimentales et ne pas avoir
un mélange des deux phases mobiles sans quoi l’exploitation des résultats
en devient difficile.
Il s’agit
d’une solution de dernier recourt car c’est une opération longue. L’ancienne
colonne doit être rincée avec un grand volume d’éluant afin
de bien enlever toute trace de solution antérieurement analysée.
Le détecteur permet de s’assurer qu’elle est bien propre. Lors de l’installation
de la nouvelle colonne, il faut là encore faire passer un volume important
de phase mobile afin de la remplir. Dans le cas où cette manipulation
est mal faite, on peut avoir des problèmes car l’échantillon remplirait
ces vides. Là encore les résultats seraient faussés car
il faudrait plus de temps pour éluer tous les composants.
On préconise
de faire circuler dix fois le volume de la colonne pour assurer le meilleur
lavage et remplissage possible.
Exploitation des résultats.
Les résultats sont fournis pas l’enregistreur sous la forme d’un chromatogramme.

A chaque pic de la courbe correspond la sortie d’un composé.
Toutes les molécules d’un soluté ne sortent pas simultanément. Il existe de nombreux trajets de longueurs différentes au travers de la colonne.

Plus le
débit de la phase mobile sera faible, plus les pics auront une base large
du fait même de la faible force d’élution du solvant.
Ce que l’on appelle
ligne de base correspond à la détection de la phase mobile seule.
Au début de la manipulation , on fait passer de la phase mobile seule
et on informe le détecteur qu’il s’agit du " zéro "
de détection. C’est la ligne de base.
Le chiffre inscrit
en haut du pic indique le temps d’élution (à la pointe du pic)
pour chacun des composés.
Ce chiffre permet
de retrouver, dans le listing des résultats, l’aire du pic correspondante.
Pour doser un composé
de concentration inconnue dans une solution, on établit tout d’abord
une gamme d’étalonnage.
Le principe
est le suivant :
On injecte des solutions
de concentrations connues que l’on élue les unes après les autres
afin de connaître la correspondance concentration ó aire du pic.
Dans l’idéal,
on essaie d’avoir une gamme d’étalonnage qui encadre la valeur présumée
de l’échantillon à doser. Ainsi on s’assure que cette valeur est
bien dans le domaine de linéarité de la droite d’étalonnage
et que l’on pourra utiliser l’équation de la droite pour trouver la concentration
inconnue.
L’équation
de la droite d’étalonnage est de la forme y = ax + b
Avec y aire
du pic
x concentration
dans la solution
a pente de la droite
b ordonnée
à l’origine (égale à zéro car si on n’a pas de composé,
on n’a pas de pic).

Connaissant
l’aire du pic de la solution inconnue et la pente de la droite étalon,
il est facile de remonter à la concentration de la solution inconnue.
Parfois, il arrive
que les résultats soient totalement inexploitables.
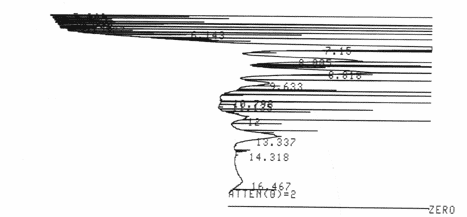
Ici, on
a saturation de la colonne. La concentration de la solution était
trop importante et on a rempli la colonne, elle est saturée. Il faut
alors la laver avec de la phase mobile pure jusqu’à ne plus obtenir de
signal sur le chromatogramme : la colonne est alors propre et on peut recommencer
avec un échantillon dilué.
On peut aussi avoir
le cas d’une pollution de la colonne lorsque la solution est trop chargée
d’éléments divers. Ils interférent tous entre eux et aucune
aire de pic n’est exploitable. Dans ce cas-là, on purifie un maximum
la solution grâce à des résines. Elles ont la capacité
de retenir un élément, ou famille d’éléments, spécifique.
On retire ainsi un maximum d’interférents dans le but de doser la solution
dans des conditions acceptables en éliminant les chevauchements de pics.
Il est à noter
que le détecteur a ces limites. Il ne peut pas déceler de composés
en dessous d’une certaine concentration, variable selon la performance du matériel.
On parle de limite de détection.
Bien que
l’HPLC soit très répandue, il existe d’autres techniques chromatographiques
qui connaissent quelques variantes par rapport à l’HPLC.
Voyons ce qu’il en
est de la CPG.
La Chromatographie en Phase Gazeuse repose sur le même principe que l’HPLC. Cependant, la phase mobile est gazeuse et on travaille à haute température (de l’ordre de 80°C).
L’appareillage.
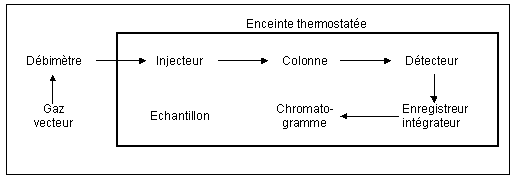
Le gaz
vecteur est la phase mobile puisque c’est lui qui va éluer la solution
tout au long de la colonne.
Le débitmètre
contrôle l’apport continu et régulier de la phase mobile. Il peut
également être présent en HPLC.
La colonne
conserve son rôle de rétention des composés en vue de leur
séparation.
Le détecteur
qui sert à repérer le passage d’un composé. Ces données
sont transmises à l’enregistreur-intégrateur qui produit le chromatogramme.
Le fonctionnement est le suivant.
On introduit une très faible quantité de mélange homogène à analyser dans l’injecteur. Ce dernier permet à la fois de porter l’échantillon à l’état de vapeur mais aussi de l’introduire dans le flux de l’éluant. L’injection doit être rapide afin de ne pas vaporiser l’échantillon dans la seringue qui sert à introduire l’échantillon dans l’injecteur. Dans le cas contraire, on aurait des pertes de matière et donc des résultats erronés.
L’ensemble du système chromatographique, de l’injecteur à l’enregistreur, est à une température suffisante pour maintenir l’échantillon à l’état de vapeur. Cette température est variable d’une analyse à l’autre. Par exemple, pour les hydrocarbures, la colonne est à 100°C, l’injecteur est le détecteur sont à 150°C. L’entrée et la sortie du système sont à des températures plus élevées que la colonne afin d’être certain d’avoir un échantillon à l’état de vapeur.
Alors que l’HPLC n’a besoin que d’un liquide vecteur, la CPG a besoin de trois gaz. Un qui élue l’échantillon et deux qui font fonctionner le détecteur.

Prenons l’exemple du FID. Le Détecteur à Ionisation de Flamme fonctionne avec de l’air et de l’hydrogène.
Ce détecteur est spécifique des molécules organiques.
Il existe
de nombreux autres détecteurs comme le détecteur à conductivité
thermique (qui a le gros avantage d’être universel) ou encore à
capture d’électrons (système radioactif nécessitant une
autorisation gouvernementale).
La CPG est très
performante mais elle a le gros inconvénient de nécessiter
une température de travail élevée. On ne peut donc
pas analyser par ce système les molécules dites thermolabiles :
celles qui ne supportent pas la chaleur. Elles seraient détruites par
la chaleur. Citons comme exemple les vitamines.
Les phases stationnaires.
En CPG,
les mécanismes de rétention sont moins efficaces qu’en HPLC aussi
on utilise des colonnes beaucoup plus longues : de 20 à 25 m.
On distingue trois
types de colonnes :
-- colonne remplie
ou à garnissage. Le " tube " est rempli d’un
support (polymère…) sur lequel on fixe la phase stationnaire (silice,
silice greffée). Le diamètre intérieur est de 2 à
3 mm.
-- colonne capillaire.
Le tube est très fin. Le diamètre intérieur est inférieur
à 0.53 mm. Les parois internes sont tapissées de phase stationnaire
(silice ou silice greffée).
-- colonne macrobore,
dont le diamètre intérieur est supérieur à 0.53
mm mais inférieur à 2 mm. Selon le même principe que pour
les autres colonnes, l’intérieur est tapissé avec la phase stationnaire.
On peut envisager :
-- une phase stationnaire liquide que l’on fixe sur un support
Cas de la colonne remplie avec un support sous forme de grains.
Cas de la colonne capillaire et macrobore si on tapisse la surface interne du tube.
Remarque :En CPG comme en HPLC, quand on parle phase stationnaire liquide, elle est en fait très visqueuse pour ne pas se mêler à la phase mobile.
-- une
phase stationnaire solide : il peut s’agir de granules dont on va remplir
la colonne ou encore un revêtement poreux sur la surface interne d’une
colonne capillaire ou macrobore.
On a ici le même
système qu’en HPLC à savoir que la silice peut être
simple ou greffée avec des groupements en carbone de longueur
variable.
La granulométrie
est de plusieurs centaines de µm. On dit alors que la colonne est peu efficace
car elle produit des pics larges (selon le même principe que décrit
pour l’HPLC).
Les phases mobiles.
Ici, on a un gaz vecteur comme éluant de l’échantillon. Il peut s’agir d’hexane (molécule linéaire de formule brute C6H14), de diazote N2 ou de dihydrogène H2. Le débit est fortement variable en fonction de la colonne : environ 30 mL/min pour une colonne remplie et environ 1 mL/min pour une colonne capillaire. Cette importante différence s’explique principalement par la différence de diamètre intérieur des colonnes.
Optimisation des conditions d’analyse.
En plus
des réglages de débit de la phase mobile que nous avons vus en
HPLC, on peut agir sur la température du four qui contient le
système chromatographique.
L’intérêt
de travailler à une température élevée est que l’on
a des molécules excitées. Elles ont donc des liaisons hydrogènes
(liaisons qui font que les matières peuvent être à l’état
liquide, solide ou gazeux selon la température et la pression) très
lâches. Elles ne sont pas très attirées les unes par rapport
aux autres. Les pics des chromatographes sont d’autant plus étendus car
les molécules n’arrivent pas en " masse " mais de
façon assez dispersée.
Quand on baisse la
température, on augmente la force des liaisons hydrogène entre
les molécules et ainsi la " cohésion " du
groupe de molécules de même nature.
Rappelons que la largeur
des pics n’est pas dictée par la seule température de travail
et le débit de l’éluant. Tout comme en HPLC, la granulométrie
joue un rôle capital. Plus les pores sont gros, plus ils peuvent loger
les molécules et les retenir.
Exploitation des résultats.
Tout comme
pour l’HPLC, on a des résultats sous forme de chromatogramme.
On exploite les résultats
selon le même principe.
C’est aussi
une technique chromatographique. Cependant elle est basée sur le caractère
électronégatif des éléments.
Agée de
moins de dix ans, cette technique propose une rapidité de séparation,
une qualité d’analyse ainsi qu’un emploi facile. Elle rivalise aisément
avec les techniques classiques d’identification des ions.
Principe.
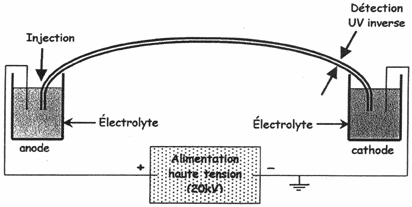
Une différence
de potentiel de 20kV est appliquée aux électrodes plongeant
dans les deux réservoirs remplis de la même solution aqueuse que
le capillaire. L’intensité ne doit pas dépasser 100 µA pour ne
pas provoquer un échauffement du capillaire.
Les ions migrent selon
deux phénomènes.
- L’électromigration :
dans toute expérience d’électrophorèse, un composé
porteur d’une charge électrique migre, sous l’influence du champ électrique
appliqué E, à une vitesse qui est la vitesse de migration électrophorétique ;
cette vitesse dépend de la charge de l’ion, de ses dimensions et de la
viscosité de l’électrolyte.
- Mobilité
électro-osmotique, flux électro-osmotique : le capillaire
étant fait de silice, ses parois sont recouvertes de sites silanols (comme
en HPLC et CPG) Si-OH qui peuvent s’ioniser si le pH est supérieur à
2 ; le tube du capillaire est alors recouvert d’une couche fixe polyanionique
(plusieurs anions) et polycationique (positive) qui se met en mouvement sous
l’influence de la différence de potentiel et migre alors vers la cathode.
Ce déplacement est appelé le Flux Electro-Osmotique ou FEO.
Ce flux permet d’entraîner toutes les molécules et éléments
présents dans le capillaire sans en modifier l’ordre de sortie et la
séparation.
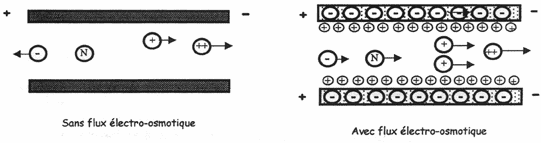
Dans cette technique, on utilise le FEO dans le but d’imposer un sens de migration à l’ensemble des espèces chargées de l’échantillon. Les espèces non chargées " suivent la marche ".
Le passage
de l’électrolyte (solution servant à entraîner les composés)
est possible grâce à un système d’aspiration. Une des deux
extrémités du capillaire est plongée dans le liquide, on
aspire à l’autre bout du capillaire. Ce système est appelé
l’injection hydrostatique. On peut appliqué le principe inverse
en effectuant une pression sur la solution à analyser pour la " pousser "
dans le capillaire.
Concernant le système
de détection, on applique la détection inverse.

Tout comme en HPLC, le détecteur mesure l’absorbance, dans la zone U.V. de la solution. Toutefois, on observe une variante. Les anions ont une très faible absorbance, il faut donc choisir un électrolyte qui aura des propriétés absorbantes importantes (exemple : le chromate).
La présence des composés dans l’électrolyte va induire un phénomène de dilution de celui-ci. De cette façon, l’absorbance de l’électrolyte dans l’U.V. va fortement diminuée au passage des composés. Ainsi on a des pics " négatifs " sur l’enregistrement car le " zéro " est fait sur l’électrolyte seul. Les appareils modernes permettent de demander une représentation " classique " des résultats.
Certains paramètres ont des techniques qui ne s’appliquent qu’à eux. Parmi ces mesures, les plus couramment utilisées sont les MES, la DCO et la DBO. Ces données étant très fréquentes dans le domaine de l’analyse de l’eau et notamment pour le contrôle des eaux usées, nous exposerons plus spécifiquement leur principe général.
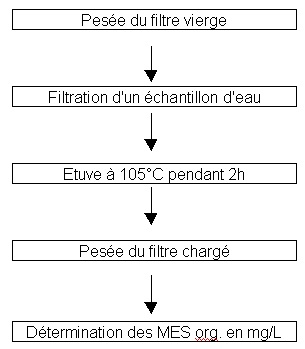
Les MES sont de deux natures. Organique et minérale.
Voici le principe d’obtention des MES organiques.
Les matières minérales s’obtiennent selon le même schéma. Le passage au four est plus long et plus chaud dans le but de détruire la matière organique pour ne garder que les matières minérales.
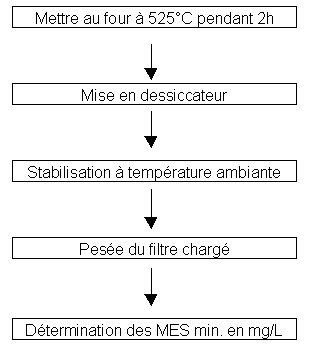
Le dessiccateur permet de stabiliser l’humidité dans l’échantillon.
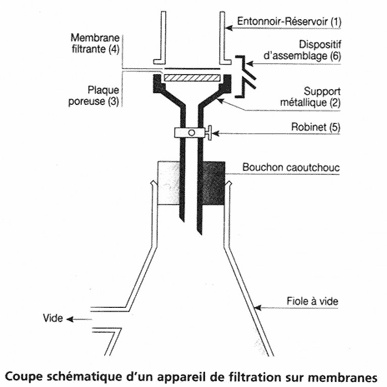
La filtration se fait de la manière suivante.
Cette donnée est obtenue en deux étapes bien distinctes.
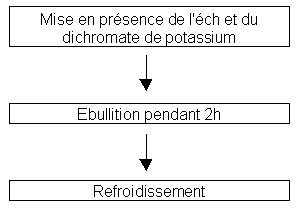
Le dichromate de potassium est un puissant oxydant qui va s’attaquer à toute la matière organique de l’échantillon
Selon le principe du dosage acido-basique, on va doser l’excès de dichromate de potassium : la quantité qui n’a pas réagi avec la matière organique de l’échantillon ; cela grâce à la solution de sel de Mohr. On connaît la quantité initiale de dichromate de potassium, on peut donc remonter à la quantité de dichromate oxydée.
La DBO5

On mesure la quantité d’oxygène dégradé au travers de processus chimique et biologique. On utilise des sondes qui mesurent la pression en oxygène. Elles rendent directement compte de la quantité d’oxygène consommée en mg/L cela grâce à une différence de pression dans le flacon.
Lors de la dégradation, du CO2 est produit. Pour éliminer cette interférence, on place 2 à 3 pastilles de soude dans le flacon de mesure. Elle a pour rôle de piéger le CO2.